在《药物生产质量管理规范》关于细胞治疗产品附录的描述中,明确要求在产品生产过程中厂房、设施与设备需要满足相对应的环境要求标准。并且要求细胞产品生产过程中应采取相应措施,尽可能避免污染和交叉污染,控制质量风险。
而一次性产品因其具备无菌性、密闭性、灵活性、单次使用避免交叉污染风险等特性,可充分契合法规的使用要求,满足相关细胞基因治疗产品工艺过程中的制备、保存及转运等需求。
CGT行业对一次性产品的质量要求及关注点
由于一次性产品会直接或间接接触CGT产品使用的生产料液及产品本身,因此也会更加关注一次性产品的生物相容性(例如 USP Class VI)、有无动物源性成分、无菌性(包括内毒素和热原控制)、溶出&析出 (E&L) 和不溶性微粒/颗粒物控制标准等内容。以下将展开介绍这些关注点及科百特所采取的控制措施:1.浸出物和可提取物
因此,评估和控制一次性产品在CGT领域物料应用产品中的浸出物,包括潜在浸出物和实际产品中浸出物是十分必要的。
*额外验证:科百特cNAS认证验证实验室,可提供客户针对其产品和接触的一次性产品进行单独的浸出物&可提取物验证测试,并提供相应验证报告文件。同时,可以根据实际工艺进行安全性评估和毒理学分析。
2.不溶性微粒/可见异物控制
颗粒物污染造成的风险严重程度通常是不可控的,其受预期的给药途径、剂量体积、颗粒特性(大小、形状、成分、数量)以及颗粒的目标位置等多因素影响。因此管理CGT领域产品生产中的颗粒物也是目前该领域所面临的挑战之一,而一次性产品的有效的颗粒物控制方式及最终产品本身不溶性微粒的标准,在应用于CGT产品时受到了更多的关注,同时也被提出了更高的要求。科百特一次性产品——助力CGT技术
细胞培养:Cobetter Lifecask RW波浪式反应袋/Lifecask RG 生物反应袋系列产品
产品整体无细胞毒性,对细胞生产无抑制作用,具有更加细胞友好性。多体积规格,满足客户定制化需求,膜材及配件自产化,供货稳定有保障。可充分满足CGT非特异性疗法中LAK(淋巴因子激活的杀伤细胞)、CIK(细胞因子诱导的杀伤细胞),特异性疗法中CAR-T(合抗原受体T细胞)、TCR-T(T细胞受体合T细胞)等不同情况下的培养及扩增环节。

流体传输及过滤:Lifecube® SA 一次性使用组件

料液配制,储存及转运:Cobetter Lifecube® 一次性使用储液袋/取样袋/搅拌袋
在培养基取样及配制、缓冲液取样及配制、细胞/中间品存储、质粒生产的收获/纯化/制剂、病毒纯化/存储、细胞料液取样、细胞产品冻存等工艺点均可以放心使用,定制化需求也可快速响应,产品相关验证齐全,生产质量管理严格,多种一次性系统配套硬件可定制匹配,可充分满足CGT工艺各种流体应用需求。
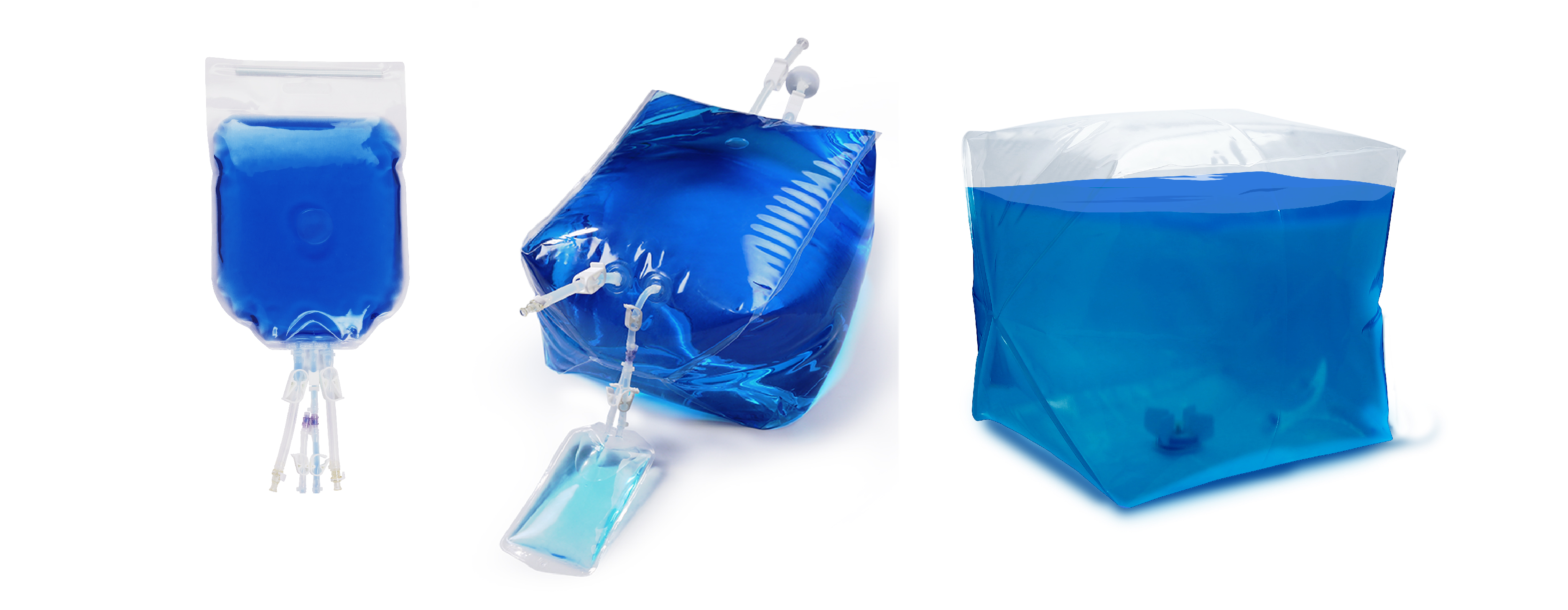
产品灌装: Cobetter Lifecube® 一次性使用灌装袋





