为验证科百特Lifecask™ RW波浪式反应袋的实际应用效果,本次实验选择20L Perfusion 款细胞培养袋结合N-1灌流工艺进行验证。验证过程使用科百特自产相关耗材、设备,本文将验证方案及结果呈现如下。
1.验证过程使用科百特相关自产耗材/设备
验证过程所使用科百特相关自产耗材、设备罗列如下:
| 名称 | 型号 |
| 20L Wave灌流培养袋 | KRW20LVNN1001 |
| 3英寸0.1μm除支原体培养基滤器 | L03HHMECBA1 |
| 5英寸0.1μm除支原体培养基滤器 | L05HHMECBA1 |
| 10L储液袋 | K2D10LC2NX05 |
| 20L储液袋 | K2D20LC2NX04 |
| 50L储液袋 | K2D50LC2NX03 |
| 16号硅胶管 | TTL |
| 16号热塑管 | TFL |
| 24号硅胶管 | TTR |
| 24号热塑管 | TFR |
| 73号硅胶管 | TTY |
| 73号热塑管 | TFY |
| 1/8等径直通 | GA1-C4LL |
| 1/4等径直通 | GA1-C4RR |
| 3/8等径直通 | GA1-C4YY |
| 1/8-1/4变径直通 | GA1-C4LR |
| 1/4-3/8变径直通 | GA1-C4RY |
| 1/8等径三通 | GA1-C6YLLL |
| 1/4等径三通 | GA1-C6YRRR |
| 3/8等径三通 | GA1-C6YYYY |
| 灭菌呼吸袋 | STPHT/STPHTJ |
表1. 验证过程使用科百特相关自产耗材
| 名称 | 型号 |
| 无菌接管机 | LMTWPA0 |
| 无菌封管机 | LMTSA0 |
| 完整性测试仪(滤器) | CT20 |
| 完整性测试仪(袋体) | CTBA0 |
表2. 验证过程使用科百特相关自产设备
2.工艺方案
以下简要介绍种子链及Wave阶段工艺调节方案。
2.1种子链
Wave接种前种子扩增工艺如下所示,为延长种子接入Wave前的恢复、适应时间,设置较长的12天种子链。
| 步骤 | 复苏 | N-3 | N-2 | N-1 | N |
| 预计培养时间(d) | 3 | 3 | 3 | 3 | 待定 |
| 培养规模 | 125ml 摇瓶 | 250ml摇瓶 | 500ml摇瓶 | 1L*3 | 20.0 L |
| 摇瓶 | 反应器 | ||||
| 初始培养体积 | 30ml | 50ml | 150ml(140-160)ml | 400ml | 7.0kg |
| (25-35)ml | (45-55)ml | (380-420)ml | (6.8-7.2)kg | ||
| 初始培养标准(106cells/ml) | 0.3 | 0.5 | 0.5 | 0.5 | 0.5 |
| (0.25-0.35) | (0.40-0.60) | (0.40-0.60) | (0.40-0.60) | (0.40-0.60) | |
| 传代标准 | 活率≥80% | 活率≥90% | 活率≥90% | 活率≥90% | NA |
| 活细胞密度:(1.00-4.00)×106 cells/mL | 活细胞密度:(2.00-5.00)×106 cells/mL | 活细胞密度:(4.00-6.00)×106 cells/mL | 活细胞密度:(4.00-6.00)×106 cells/mL |
表3.种子扩增方案
2.2培养工艺
1.向Wave中注入基础培养基6.2L,预热培养基,时间:0.5-12h,温度设定值
为36.5℃,范围:36.0-37.0 ℃,启动温度控制Auto模式;
2.接种前进行DO电极100%校准,取样离线检测后对pH电极进行一点校准;
3.Wave接种后活细胞密度:0.5×106 cells/mL,范围:(0.40-0.60)×106cells/mL;
4.初始培养体积:7.0 kg,操作范围7.0±0.2 kg;
5.设置初始Rocker Speed:24.0 RPM,手动调节相关参数;
6.设置初始Rocker Angle:8°,手动调节相关参数;
7.pH设置值:6.95,范围:6.65-7.25,启动pH关联控制(CO2/Base);
8.DO设置值:40%,启动溶氧关联控制(O2);
9.Gas Flow Rate初始设置值:0.3 LPM,范围:0.2-1.0 LPM,自动控制模式;
10.在接种后第3天至第n天,补加基础培养基(Dynamis);
11.在接种后第3天至第n天,添加补料(Feed C);
12.初步设定基础培养基与补料培养基的灌流比为19:1;
13.开启灌流前对Feed1泵、Feed2泵及Harvest泵进行校准;
14.设置Harvest泵速大于补料泵速之和,将培养体积控制在袋体最小灌流培养体积;
15.灌流速率调整方式如下:
3.数据总结与分析
根据日常检测参数制图1-7,如下所示:
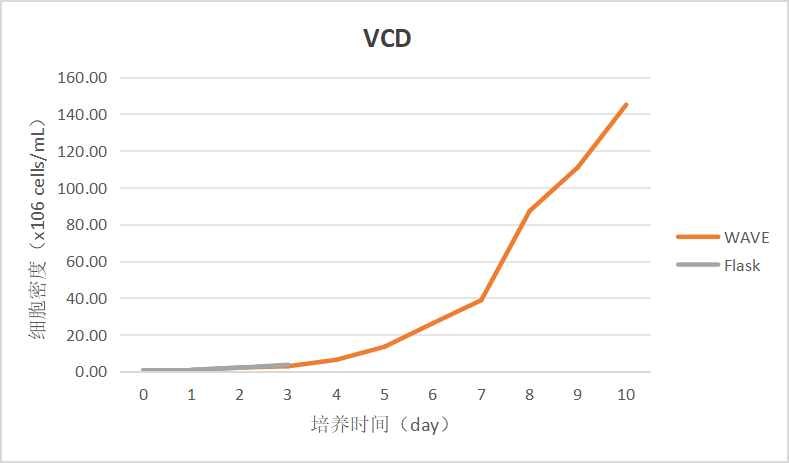
图1 活细胞密度增长趋势图
Wave接种后,将前3天数据与同步摇瓶对比,除Day 1-Day 2期间细胞密度完成翻倍,μ值0.9左右外,其余时间细胞增长缓慢,分析该细胞株复苏后状态不佳,仍在适应状态。开启灌流后细胞状态逐渐恢复,结合补料策略的调整,活细胞密度整体呈稳步提升态势。
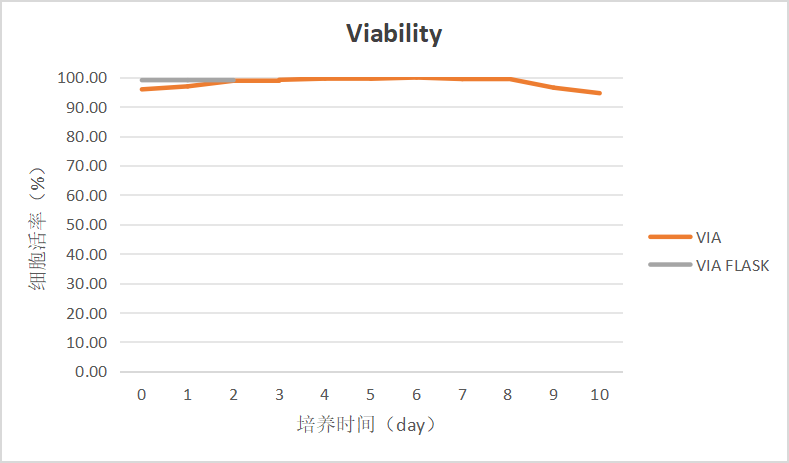
图2 细胞活率变化趋势图
该批次灌流培养大部分时间内细胞活率维持在95%以上,细胞适应培养环境、恢复期间,活率未出现明显下降情况。
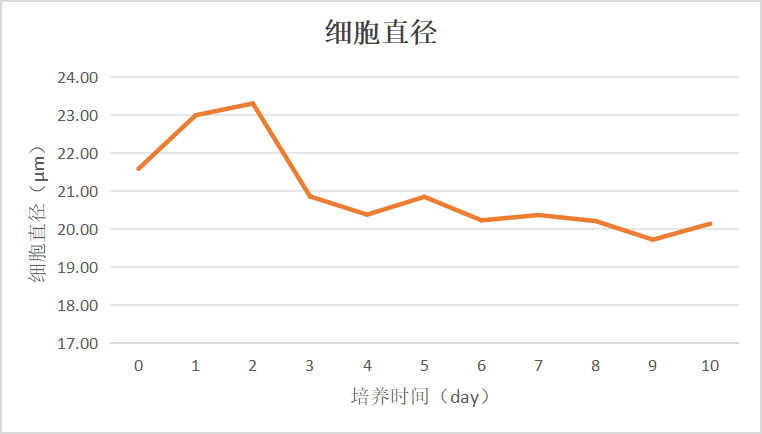
图3 活细胞直径变化趋势图
Day 1-Day 3,即灌流开启之前,活细胞直径在20.5-23.5μm之间变化,灌流期间在19.5-21μm之间波动,相对稳定。
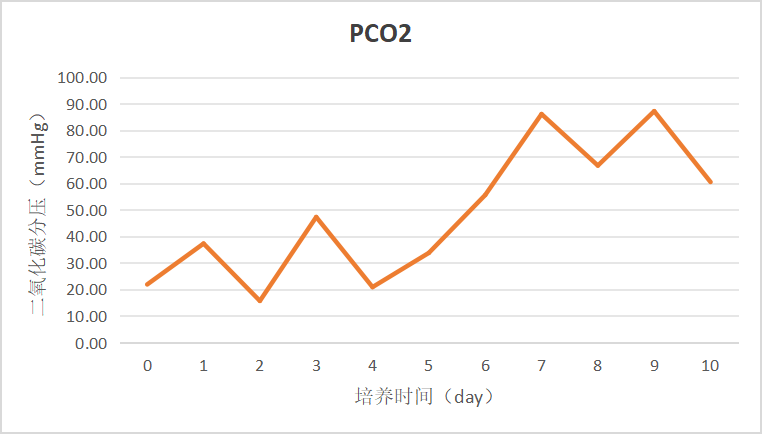
图4 二氧化碳分压变化趋势图
灌流开启前PCO2数值相对稳定,在50 mmHg以内,随着灌流模式的开启,细胞迅速增长,CO2排出量随之增加,PCO2在Day 7达到85 mmHg。Day 6日常参数检测后将灌流速率由1.5 vvd调整为2.0 vvd,并增大通气速率,Day 8 PCO2有所下降。Day 9将通气速率调整为系统允许上限值1 L/min,继续提高灌流速率至2.5 vvd,Day 10 PCO2下降至60 mmHg左右,可见提高灌流速率及通气速率能够有效排出体系中的CO2,降低PCO2。
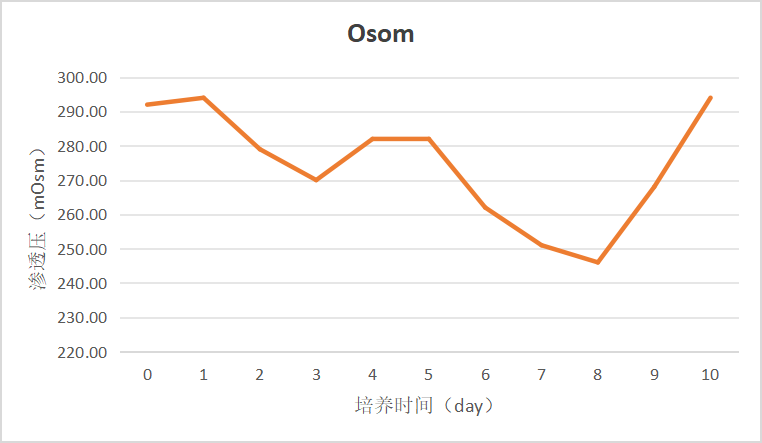
图5 渗透压变化趋势图
此次验证期间检测手段有限,由于培养体系渗透压主要受葡萄糖含量的影响,以渗透压数值反映残糖含量。Dynamis基础培养基初始渗透压290-300 mOsm,Day 1-Day 3随着残糖量下降渗透压也持续下降,Day 3开启灌流后,不断注入的新鲜培养基使培养体系中渗透压得以回升,Day 5-Day 8随着活细胞密度的快速增长、灌流速率大幅提升(1.0 vvd-2.0 vvd)以及灌流补料占比的小幅提升(Dynamis:Feed C,由20:1调整至14:1)也无法有效提高体系中的渗透压,Day 8 调整Feed C补料灌流速率占比至1/6,渗透压得以快速提升,即细胞培养环境中糖浓度得以有效恢复。
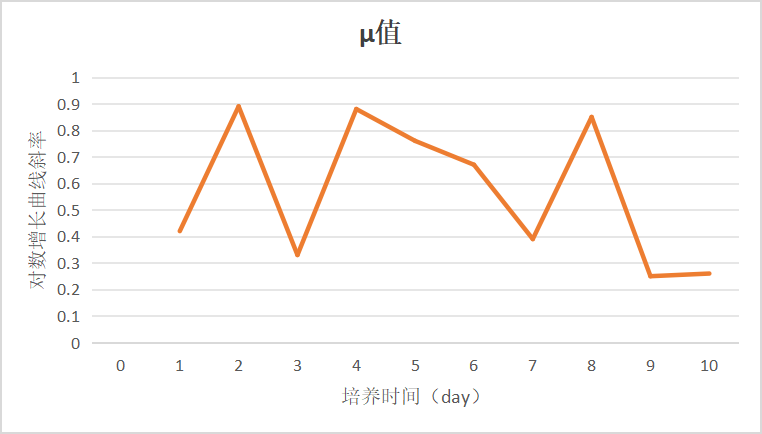
图6 活细胞增长μ值变化趋势图
由图中可以看出,共有3段μ值明显下降的区间,即Day 2-Day 3,Day 6-Day 7,Day 8-Day 9,结合整个批次运行情况分析3段细胞增长趋势放缓的原因分别为,细胞适应/恢复阶段、补料调整不及时、细胞密度较高和培养体系受限。
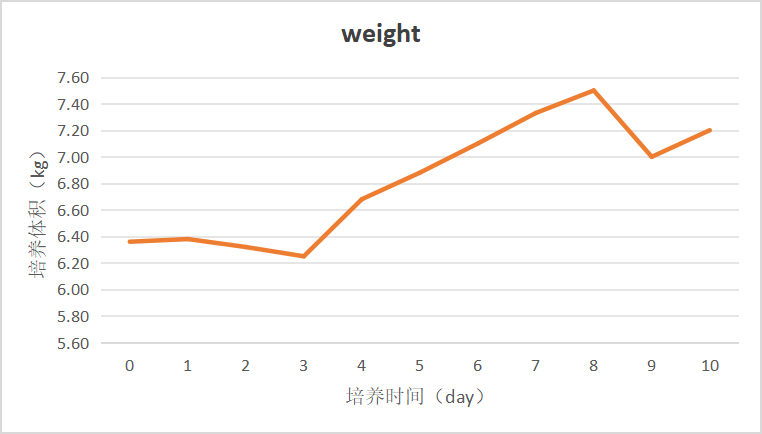
图7 培养体积变化趋势图
本验证批次设置Dynamis+Feed C 2路补料,使用手动方式控制培养体积。接种后初始培养体积在6.40 kg左右,随着尾气蒸发量的排出,在Day 3时培养体积降至6.20 kg。开启灌流模式后,观察到harvest端有持续气泡抽出的情况,为确定自产20L灌流袋的实际最低灌流体积,设置harvest流速大于补料流速之和,培养体积持续上升至6.70 kg左右后可保持稳定,可见此款Wave反应袋最小灌流培养体积为6.70 kg。Day 4-Day 8体积上升推测为截留膜孔逐渐堵塞所致,使实际泵出流速低于设定值。Day 8-Day 9培养体积下降为手动调节的结果。
本批次自产Wave灌流袋N-1细胞培养验证于Day 10 结束培养,终活细胞密度 145 ×106 cells/mL,活率 94%。Day 9 活细胞密度超过100 ×106 cells/mL后,活率开始下降,若将该灌流工艺用于N-1种子阶段,建议将活细胞密度控制在100 ×106 cells/mL以内,即培养至Day 8左右,此时细胞状态良好,适于作为N级种子使用。
4.后续工艺优化方案
1.增加葡萄糖、乳酸等生化指标检测手段,根据渗透压及葡萄糖含量调整培养中后期Feed C或高糖补料的添加比例,例如在本次培养过程中将Day8的灌流比调整为10:1,在满足细胞生长需求的同时降低培养体系的粘度,减小膜孔堵塞风险;
2.少量、多次添加消泡剂,或在培养基配置时额外添加一定量PF68,尽量避免消泡剂添加造成溶氧大幅波动的情况;
3.根据细胞生长特性,可适当提前开启灌流,提高培养前期细胞倍增速率。
5.结语
此次验证结果表明科百特Lifecask™ RW 20L Perfusion款反应袋在N-1灌流工艺条件下综合表现良好,可满足相应的使用需求。科百特应用验证平台也将不断优化验证工艺,尝试将不同细胞株与培养基组合,对Lifecask™ RW系列产品进行持续的验证,为客户在选择相关产品时提供更多的数据支持。
同时该验证批次使用多款科百特自研设备、耗材,良好的应用表现也为客户在进行国产化替代时提供更多更优选择。




