概述
特性优点
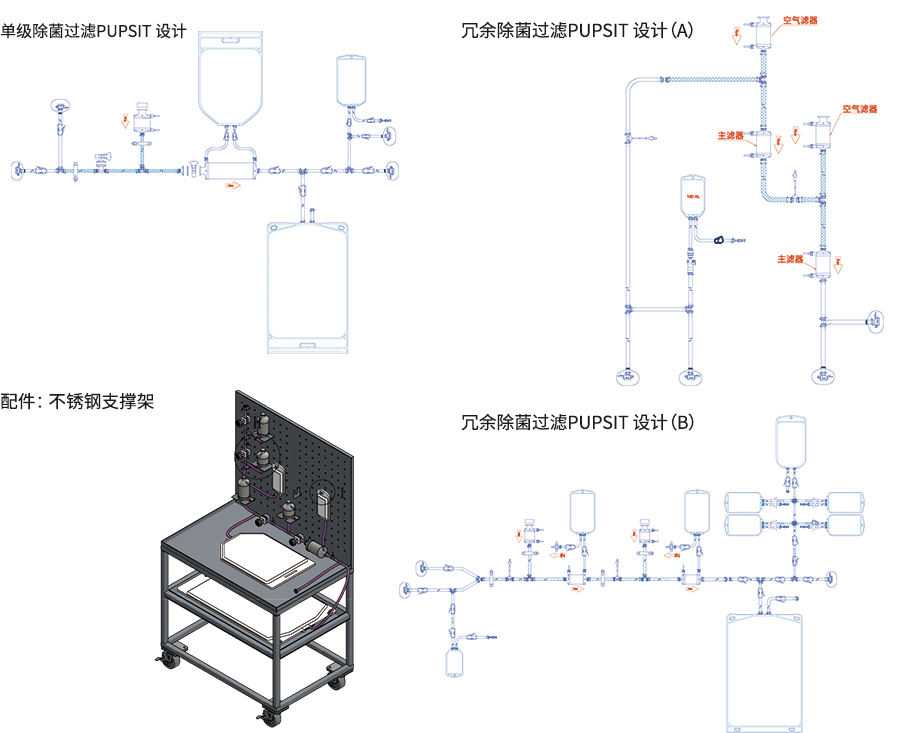
1. 符合 EU GMP Annex 1 要求
系统可执行过滤器的 PUPSIT,且保证过滤器使用前后系统始终保持无菌状态
选配组件(CTO:按订单配置)- 设计灵活
定制化方案(ETO:按订单设计)- 满足复杂设计需求
系统可执行过滤器的 PUPSIT,且保证过滤器使用前后系统始终保持无菌状态
2. 高度的设计灵活性,可满足多种应用场景及实现较少的产品损失
强大的一次性产品系列,种类全、型号多,包括囊式过滤器、一次性储液袋、管子、无菌连接器、转接头、分支接头、压力仪表接头、在线压力传感器/监测设备等,可满足几乎所有的终端除菌过滤需求3. 货期短
预先组装及可全自产组件组装,省去 50% 以上的等待时间,最短 2 周交付4. 提供标准化和特殊定制的解决方案
标准化设计组件(PDS:预设计解决方案)- 货期短选配组件(CTO:按订单配置)- 设计灵活
定制化方案(ETO:按订单设计)- 满足复杂设计需求
典型应用
- 终端除菌过滤(欧盟申报必须)
产品性能
其他特点
- 设计充分考虑到实际工艺需求和车间布局,如预冲洗、产品顶洗、工艺压力、气源水源等因素,推荐合适的袋体体积、管路长短及组合方式
- 可实现高泡点过滤器的 PUPSIT
- 可冲洗的组件均进行预清洗处理,有效降低不溶性微粒和可提取物水平
- 预先辐照灭菌的双层无菌包装,特殊需要可定制三层包装,满足用于满足客户不同洁净区脱包需求
- 全自产组件,保证良好的质量追溯
- 丰富的支持文件,包括验证指南、可提取物数据、系统选配指南、使用说明、经验参数等
质量保证
- 100% 完整性测试
- ISO® 9001:2015 质量管理体系
- ISO 4.8 级洁净区生产 (相当于洁净度 A 级)
- 按 USP<87>体外生物安全性测试无毒性
- 符合 USP<88>第 VI 等级塑料体内生物安全性要求
- 细菌内毒素符合注射用水要求(<0.25 EU/mL)
- 不溶性微粒符合《中国药典》2020 年版 四部 大容量注射液要求(同 USP<788>)
- 按 ISO11137 进行伽马辐照剂量验证,无菌包装
关键性能验证
- 泄漏测试
- 耐压测试
- 连接强度测试
订购信息
根据客户需求提供定制化设计,示例如下: